免疫细胞化学
免疫细胞化学(immunocytochemistry,ICC)是利用标记的抗体对细胞内的靶抗原进行定位和定量的一种技术。标记抗体检测抗原的方法有两种:直接法和间接法。直接法是标记抗体直接对抗原进行检测;间接法是先用一抗识别抗原,再用标记二抗识别一抗。通过呈色反应或荧光对细胞中抗原进行定位定量。免疫细胞化学和免疫组织化学都是免疫学的分支,二者在检测原理上相同。
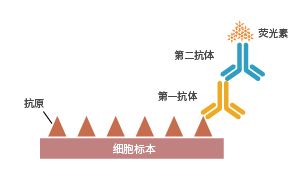
抗原抗体检测方法
| 直接法 | 间接法 | |
|---|---|---|
| 原理 |  |
 |
| 优点 |
|
|
| 缺点 |
|
|
除了直接法和间接法,常见的抗体检测抗原的方法还有夹心法和竞争法,详情可查看ELISA实验技术。
抗体的标记
| 标记方法 | 介绍 |
|---|---|
| HRP 辣根过氧化物酶标记,结合相应底物显色后观察 | HRP与不同的底物反应产生不同的信号。该标记方法对于封固介质的免疫组化染色应用较为理想。且需要阻断组织的内源性过氧化物酶 |
| AP碱性磷酸酶标记 | 是一种能够将对应底物去磷酸化的酶,通过水解磷酸单酯将底物(蛋白、核酸等)分子上的磷酸基团除去。酶将奈酚磷酸(底物)水解成酚类和磷酸。酚和无色的重氮盐(显色原)结合而产生有色的、不溶性偶氮染料。此标记在检测时需要对组织中的碱性磷酸酶灭活 |
| FITC异硫氰酸荧光素标记 | 硫氰酸基团可以和蛋白质上的伯胺基团反应形成硫脲键,从而实现对生物活性物质的荧光标记,发出绿色荧光,直接用荧光显微镜观察 |
| 生物素标记 | 生物素与抗体结合且不影响抗体的活性,是理想的标记剂。且一个抗体分子可偶联数十个生物素形成一个生物放大系统,显著提高了检测灵敏度 |
ICC实验的优化
抗体的选择
在设计免疫细胞化学实验中,抗体的选择至关重要。选择的标准是要减少实验的非特异性染色,一般根据实验要求选择具有最小交叉反应的高质量抗体。
- 抗体类型:在抗原抗体结合过程中,温度、酸碱度以及盐浓度的变化等都会影响抗体识别抗原表位途径的变化或是被破坏。单克隆抗体特异性强,但亲和力相对小容易受到蛋白质构象变化的影响;多克隆抗体是异质的,不受蛋白构象变化的影响。一般而言在一定的酸碱度和盐浓度范围内,多克隆抗体也比单克隆抗体更稳定,多克隆抗体比单克隆抗体更常用于ICC实验。
- 种属来源:根据一抗的来源决定二抗的选择。若一抗是小鼠来源,那么二抗选择抗小鼠的即可。
- 根据实验目的是检测什么种属的抗原选择抗体,避免出现交叉反应。
固定剂的选择
目前的免疫细胞化学实验中固定剂常见为甲醛类和戊二醇类,下面介绍5种常见固定剂以供实验选择。
- 95%酒精:常用的细胞固定液,可加入1%的冰醋酸用来增强固定效果,且减少了酒精固定时产生的收缩作用。
- 乙醚酒精固定液:有95%酒精49.5ml、乙醚49.5ml、冰醋酸1ml组成。固定效果较好,但乙醚易燃易挥发且价格较贵,故应用很少。
- Carnoy液:由无水酒精:氯仿:冰醋酸=6:3:1组成,固定液穿透力强,固定效果好。一般只用于核酸、糖原和粘蛋白等特殊染色中应用。
- 甲醇:固定效果好,核结构保存清晰。常用于瑞氏、MGG染色或免疫组化染色的自然干燥涂片预固定。
- 丙酮:穿透力强,对酶类固定效果好,常用于酶的组织化学染色固定。
固定时需要注意:
- 根据染色要求和固定液特点选择合适的固定液。如巴氏HE染色则选用95%酒精;MGG染色选用甲醇固定液;瑞氏染色以空气干燥固定为宜。
- 防止交叉污染,保护固定液浓度。一般酒精固定液浓度低于90%以下时不作为固定液使用。
- 液体标本在涂片后可在空气中放置片刻,待涂膜周边稍干而中间未干时浸入固定液中固定效果更好。
